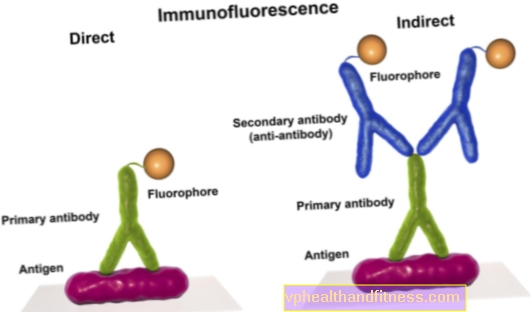
Μέχρι πριν από λίγα χρόνια, οι ασθενείς με μυϊκή ατροφία της σπονδυλικής στήλης μπορούσαν να λάβουν μέρος μόνο σε κλινικές δοκιμές νέων φαρμάκων, να κάνουν φυσική θεραπεία και θεραπείες για τη βελτίωση της ποιότητας ζωής - και να περιμένουν κάποιον να αναπτύξει τελικά μια αποτελεσματική θεραπεία. Ζουν για να το δουν: πρόσφατα, η ανάπτυξη της SMA μπορεί να σταματήσει, επειδή υπάρχει διαθέσιμο φάρμακο που επιβραδύνει την πορεία της νόσου και δίνει πολλούς ασθενείς ελπίδα για ανεξαρτησία.
Υπάρχει μια αποτελεσματική θεραπεία για την SMA, ανακοίνωσαν πρόσφατα οι ερευνητές. Ωστόσο, η ιστορία της θεραπείας της μυϊκής ατροφίας της σπονδυλικής στήλης δεν είναι μακρά - μια αποτελεσματική θεραπεία για την ασθένεια έχει αναζητηθεί εδώ και χρόνια.
Το SMA είναι μια από τις σπάνιες ασθένειες που μπορούν να εμφανιστούν σε βρέφη, αλλά δεν μπορεί να ανιχνευθεί σε οποιοδήποτε υπερηχογράφημα που διατάσσεται κατά τη διάρκεια της εγκυμοσύνης. Στην οξεία του μορφή, εμφανίζεται τις πρώτες εβδομάδες ή τους μήνες της ζωής.
Οι γονείς παρατηρούν ότι το μωρό, το οποίο έχει αναπτυχθεί αρμονικά μέχρι στιγμής, ξαφνικά αρχίζει να κουράζεται εύκολα, απορροφά και αναπνέει με δυσκολία, κλαίει πολύ ήσυχα, ή πραγματικά χτυπά, επειδή δεν έχει δύναμη για οτιδήποτε άλλο. Η ασθένεια αναπτύσσεται επίσης σε μεγαλύτερα παιδιά, καθώς και σε εφήβους και ενήλικες (και όσο αργότερα εμφανίζονται τα πρώτα συμπτώματα, τόσο ηπιότερη είναι συνήθως).
Οι ασθενείς με μυϊκή ατροφία της σπονδυλικής στήλης χάνουν σταδιακά την ικανότητα να ελέγχουν το σώμα τους καθώς οι μύες τους γίνονται όλο και πιο αδύναμοι. Τα περισσότερα από αυτά περιορίζονται σε αναπηρικό καροτσάκι μετά από λίγο και χρειάζονται βοήθεια σε κάθε, ακόμη και την πιο απλή, δραστηριότητα.
Όλα αυτά τα συμπτώματα προκαλούνται από ανεπάρκεια στην παραγωγή της πρωτεΐνης SMN (υπεύθυνη για τη σωστή λειτουργία των κινητικών νευρώνων), η οποία εμφανίζεται ως αποτέλεσμα σφάλματος στο γονίδιο SMN1 που βρίσκεται στο 5ο χρωμόσωμα. Όταν δεν υπάρχει αρκετή από αυτήν την πρωτεΐνη, οι νευρώνες πεθαίνουν και οι μύες αρχίζουν να ατροφούν, οδηγώντας σε μερική ή ακόμη και πλήρη παράλυση.
Στην Πολωνία, ένα στα 35 άτομα έχει μετάλλαξη στο γονίδιο που είναι υπεύθυνο για την κωδικοποίηση της πρωτεΐνης SMN.Εάν το έχουν και οι δύο γονείς, ο κίνδυνος ενός παιδιού να έχει SMA είναι 25 τοις εκατό. Εκτιμάται ότι κάθε χρόνο στη χώρα μας γεννιούνται 40 μωρά με μυϊκή ατροφία της σπονδυλικής στήλης.
Άνεση ζωής για ασθενείς με SMA
Τα συμπτώματα της μυϊκής ατροφίας της σπονδυλικής στήλης είναι γνωστά εδώ και αιώνες και η πρώτη επίσημη περιγραφή της νόσου που είναι γνωστή στην ιατρική χρονολογείται από το 1891 - τότε ο Αυστριακός νευρολόγος Guido Werdnig περιέγραψε τη βρεφική του μορφή. Δεδομένου ότι μια παρόμοια περιγραφή γράφτηκε σχεδόν ταυτόχρονα από έναν άλλο νευρολόγο, τον Γερμανό Johann Hoffmann, αυτή η μορφή SMA αναφέρεται επίσης ως σύνδρομο Werdnig-Hoffmann.
Για πολλά χρόνια δεν υπήρχε αποτελεσματική θεραπεία. Προκειμένου να παρέχεται στους ασθενείς άνεση ζωής, και σε ορισμένες μορφές της νόσου να επεκταθεί ο χρόνος που είναι σχετικά ανεξάρτητοι, εφαρμόστηκε συμπτωματική θεραπεία: φυσική θεραπεία, ορθοπεδική θεραπεία και αναπνευστική υποστήριξη. Όσο ο ασθενής περπατούσε, ο στόχος της θεραπείας ήταν να παρατείνει αυτήν την κατάσταση όσο το δυνατόν περισσότερο, βελτιώνοντας - μέσω καθημερινής, ατομικής αποκατάστασης - μυϊκή δύναμη, αναπνευστική απόδοση - και αποτρέποντας τις συσπάσεις των αρθρώσεων.
Πολλά, ωστόσο, εξαρτώνται από την κατάσταση του ασθενούς και από το βαθμό στον οποίο είχε αναπηρία. Στην περίπτωση ατόμων των οποίων η ασθένεια ήταν εντελώς ακινητοποιημένη, καταβλήθηκαν προσπάθειες για την πρόληψη της ανάπτυξης σκολίωσης, συσπάσεων και αναπνευστικής ανεπάρκειας.
Δυσκολίες στη θεραπεία της SMA
Η γενετική βάση του SMA περιγράφηκε το 2005 και από τότε, η εργασία σε φάρμακα που θα μπορούσαν να αντιστρέψουν την ανεπάρκεια της πρωτεΐνης SMN είναι σε πλήρη ταχύτητα. Έχουν δοκιμαστεί αρκετές ουσίες για τη θεραπεία της μυϊκής ατροφίας της σπονδυλικής στήλης, τόσο αυτές που αποσκοπούν στην επιδιόρθωση ενός «ελαττωματικού» γονιδίου όσο και εκείνων που θα αυξάνουν την ποσότητα της πρωτεΐνης SMN.
Χημικές ενώσεις που αύξησαν τη δραστικότητα του γονιδίου SMN2 (το δίδυμο γονίδιο SMN1, το οποίο παράγει επίσης την πρωτεΐνη SMN, αλλά σε ανεπαρκείς ποσότητες) έχουν πειραματιστεί - αυξητική ορμόνη, προλακτίνη, φάρμακα που χρησιμοποιούνται για τη θεραπεία καρκίνου ή φάρμακα από την κατηγορία αναστολέων της ακετυλάσης της ιστόνης είναι μόνο μερικά από αυτά.
Οι ερευνητές εξέτασαν επίσης τις φυσικές πολυφαινόλες (κουρκουμίνη, ρεσβερατόλη), αμινογλυκοσίδες και ουσίες που βοήθησαν σε παρόμοιες περιπτώσεις σε ζώα - βουτυρικό νάτριο και φαινυλοβουτυρικό νάτριο. Μόλις διαπιστώθηκε ότι ορισμένοι ασθενείς βοηθούνται από βαλπροϊκό οξύ σε συνδυασμό με L-καρνιτίνη: δυστυχώς, αποδείχθηκε ότι στις περισσότερες περιπτώσεις αυτή η ουσία δεν έχει καμία επίδραση.
Υπήρχε επίσης κάποια ελπίδα για την ορμόνη TRH, η οποία υποτίθεται ότι θα αποτρέψει το θάνατο των νευρώνων, και μια ουσία που έχει χρησιμοποιηθεί επιτυχώς για τη θεραπεία της αμυοτροφικής πλευρικής σκλήρυνσης - αυτές επίσης αποδείχθηκαν αποστειρωμένες, όπως έχουν προκαλέσει βλαστικά κύτταρα.
Νέες προοπτικές στη θεραπεία της SMA
Σχεδόν 120 χρόνια αφότου περιγράφηκε για πρώτη φορά η ασθένεια, εμφανίστηκε ένα φως στη σήραγγα: οι επιστήμονες άρχισαν να αναρωτιούνται εάν ήταν δυνατόν να τροποποιηθεί η συναρμολόγηση του γονιδίου SMN2 για την κωδικοποίηση περισσότερων της πρωτεΐνης SMN. Κατά τη διάρκεια της έρευνας, παρατηρήθηκε ότι τέτοιες ιδιότητες έχουν έναν αριθμό ουσιών, συμπεριλαμβανομένων των αμινογλυκοσίδων και των αντιβιοτικών από την ομάδα τετρακυκλίνης.
Το 2008 αποδείχθηκε ότι το γονίδιο SMN2 μπορεί να τροποποιηθεί με τη βοήθεια συνθετικών ολιγονουκλεοτιδίων. Πέντε χρόνια αργότερα, ξεκίνησαν οι κλινικές δοκιμές της πρώτης φαρμακευτικής ουσίας που περιείχαν συνθετικά νουκλεοτίδια, που προκάλεσαν μεγάλες ελπίδες από ειδικούς.
Σύντομα, διερευνήθηκαν και άλλα μόρια: η branaplam (αύξηση του επιπέδου της πρωτεΐνης SMN τροποποιώντας τη συναρμολόγηση του προ-mRNA του γονιδίου SMN2, RG7800 (το οποίο τροποποίησε τη συναρμολόγηση του γονιδίου SMN2 έτσι ώστε να σχηματιστούν σημαντικές ποσότητες της πρωτεΐνης SMN που λείπει) και μια ουσία που ονομάζεται ριστιπλάμη, η οποία αύξησε σημαντικά την ποσότητα Πρωτεΐνες SMN σε όλους τους ιστούς.
Επί του παρόντος, το branaplam βρίσκεται ακόμη στη φάση της έρευνας, ενώ τα αποτελέσματα της έρευνας για το risdiplam είναι τόσο ελπιδοφόρα που ο κατασκευαστής αυτής της ουσίας έχει υποβάλει αίτηση έγκρισης στις ΗΠΑ για τη θεραπεία όλων των μορφών SMA. Ωστόσο, στη φάση της κλινικής δοκιμής, υπάρχουν δύο μόρια που δρουν για την ενίσχυση των μυών των ασθενών με SMA: reldesemtiv και SRK-015.
Επιτυχία στη θεραπεία της SMA
Η 23 Δεκεμβρίου 2016 είναι μια σημαντική ανακάλυψη στη θεραπεία της SMA: αυτήν την ημέρα, ο κατασκευαστής του φαρμάκου που βασίζεται σε συνθετικά νουκλεοτίδια έλαβε έγκριση από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για να εισαγάγει αυτήν την ουσία για τη θεραπεία όλων των μορφών αυτής της ασθένειας στις ΗΠΑ και σε χώρες που ισχύουν άμεσα για απόφαση FDA.
Στις 30 Δεκεμβρίου 2017, μια παρόμοια απόφαση εκδόθηκε από την Ευρωπαϊκή Επιτροπή, επιτρέποντας στο φάρμακο να θεραπεύει όλες τις μορφές SMA σε χώρες της ΕΕ. Ο πρώτος Πολωνός ασθενής συμπεριλήφθηκε στο πρόγραμμα ναρκωτικών στις 27 Φεβρουαρίου 2019. Επί του παρόντος, όπως τόνισε ο καθηγητής. Δρ hab. n. med. Maria Mazurkiewicz-Bełdzińska, επικεφαλής του Τμήματος Αναπτυξιακής Νευρολογίας στο Ιατρικό Πανεπιστήμιο του Γκντανσκ, η θεραπεία καλύπτει όλους τους Πολωνούς ασθενείς με SMA, ανεξάρτητα από την ηλικία και τον τύπο της νόσου.
Τι γνωρίζουμε για αυτό το φάρμακο; Είναι ένα ολιγονουκλεοτίδιο, ένα συνθετικό θραύσμα DNA. Το μόριο αυτής της ουσίας είναι τόσο μεγάλο που δεν διασχίζει το φράγμα αίματος-εγκεφάλου, επομένως το φάρμακο πρέπει να χορηγείται απευθείας στο εγκεφαλονωτιαίο υγρό που περιβάλλει τον νωτιαίο μυελό - μόνο αυτός ο τρόπος εφαρμογής του επιτρέπει να φτάσει στους κινητικούς νευρώνες που αποτελούν μέρος του νωτιαίου μυελού κορδόνι.
Μετά τη χορήγηση, διεισδύει στον κυτταρικό πυρήνα των κινητικών νευρώνων και τροποποιεί τη συναρμολόγηση του γονιδίου SMN2 με τέτοιο τρόπο ώστε να αρχίζει να κωδικοποιεί περισσότερο από ό, τι πριν από την πρωτεΐνη SMN, "αναλαμβάνοντας" τη λειτουργία του γονιδίου SMN1. Η θεραπεία σε συνδυασμό με την καθημερινή αποκατάσταση αναστέλλει την πρόοδο της νόσου και βελτιώνει την υγεία σε πολλούς ασθενείς. Αλλά όχι όλα: ως καθηγητής Δρ hab. n.med. Maria Mazurkiewicz-Bełdzińska, το φάρμακο δεν είναι σε θέση να αποκαταστήσει την αποτελεσματικότητα εκείνων των ατόμων των οποίων το νευρικό σύστημα έχει υποστεί βλάβη λόγω της εξέλιξης της SMA και που δεν είναι σε θέση να μετακινήσουν τους μυς τους μόνες τους.
Ωστόσο, η χορήγηση του φαρμάκου όταν ο ασθενής είναι ακόμα σχετικά κατάλληλος, και επομένως στην αρχή της νόσου, επιτρέπει τη διαμόρφωση του κατεστραμμένου γονιδίου σε τέτοιο βαθμό ώστε να αποτρέπονται περαιτέρω εκφυλιστικές αλλαγές.
Δίνοντας το φάρμακο σε βρέφη πριν εμφανιστούν τα πρώτα συμπτώματα, μπορεί επίσης να προληφθεί η ανάπτυξη της πιο σοβαρής μορφής της νόσου - SMA01. Αυτό επιβεβαιώθηκε από τη μελέτη NURTURE που διεξήχθη από το 2015, η οποία περιελάμβανε νεογέννητα με γενετικά αποδεδειγμένη μυϊκή ατροφία της σπονδυλικής στήλης που δεν είχαν ακόμη αναπτύξει συμπτώματα της νόσου - καθένα από τα 25 παιδιά σε πρώιμη θεραπεία μπορεί να καθίσει χωρίς υποστήριξη και 22 από αυτά είναι σε θέση να περπατήσουν ανεξάρτητα .
Τα περισσότερα από αυτά τα παιδιά απέκτησαν αυτές τις δεξιότητες ταυτόχρονα με τα υγιή παιδιά. Επομένως, τόσο οι γιατροί όσο και οι γονείς των παιδιών με SMA ζητούν τώρα από όλα τα νεογέννητα να υποβληθούν σε έλεγχο για SMA, χάρη στα οποία άρρωστα παιδιά θα μπορούσαν να λάβουν το φάρμακο την πρώτη εβδομάδα της ζωής.
Προτεινόμενο άρθρο:
Η ιστορία ενός εργατικού Μπεν, του οποίου οι μύες σταμάτησαν να "εξαφανίζονται"Προτεινόμενο άρθρο:
Ουάου, Ανέτα, δεν έχετε καθόλου μύες και μπορείτε να το κάνετε! Γονιδιακή θεραπεία για SMAΑπό τον Μάιο του 2019, μια φαρμακευτική ουσία για γονιδιακή θεραπεία σε παιδιά έως 2 ετών είναι επίσης διαθέσιμη στις ΗΠΑ. Αυτή η ουσία περιέχει ιούς από την οικογένεια scAAV9 - μετά τη χορήγηση, εισέρχονται στα κύτταρα των κινητικών νευρώνων, μεταδίδοντας στον πυρήνα μια συνθετική αλληλουχία DNA που αντιστοιχεί στο γονίδιο SMN1. Η κωδικοποίηση της πρωτεΐνης SMN που λείπει ξεκινά σχεδόν αμέσως, και το επίπεδό της αυξάνεται σημαντικά τις επόμενες ημέρες, γι 'αυτό το φάρμακο είναι ιδιαίτερα αποτελεσματικό στη θεραπεία των βρεφών, καθώς αναπτύσσουν την ασθένεια πιο γρήγορα. Το φάρμακο μπορεί να χορηγηθεί μόνο μία φορά, καθώς μετά την εφαρμογή του, το σώμα αναπτύσσει μόνιμη ανοσία στον ιό. Δεν μπορεί να ληφθεί από άτομα που έχουν ανοσία σε αυτόν τον ιό (εκτιμήσεις δείχνουν ότι έως και το 50% των ενηλίκων είναι ανοσοποιημένοι) Επί του παρόντος, το φάρμακο χορηγείται ενδοφλεβίως και ο κατασκευαστής εργάζεται σε μια μορφή που χορηγείται με οσφυϊκή παρακέντηση και η διαδικασία έγκρισης του φαρμάκου βρίσκεται σε εξέλιξη στην Ευρωπαϊκή Ένωση.